¿Cómo medir cambios en el volumen del cerebro a lo largo de los años?
En Entelai estamos trabajando para incorporar a nuestros reportes volumétricos de resonancias estructurales de cerebro información comparativa con estudios previos. Este tipo de comparaciones longitudinales aportan información muy valiosa para seguir la evolución de los pacientes a lo largo del tiempo. Aquí, es muy importante diferenciar los cambios en el volumen del cerebro producto del envejecimiento natural o variaciones normales o de medición, de aquellos cambios que pueden resultar de algún proceso patológico. Contar con herramientas que pueden medir ese cambio, y a su vez, establecer si la magnitud del mismo está dentro del envejecimiento natural; es de gran utilidad para la toma de decisiones en el reporte de los neuroradiólogos y en las decisiones diagnóstico-terapéuticas de los neurólogos .
En este artículo describimos algunos de los principales desafíos que enfrentamos a la hora de hacer este tipo de comparaciones y las herramientas que estamos usando para resolverlos.
¿Qué queremos comparar?
A la salida de nuestras redes neuronales contamos con una segmentación tridimensional del cerebro separado en más de 50 áreas distintas incluyendo estructuras corticales, subcorticales y una máscara global del volumen intracraneal. Todas nuestras mediciones y comparaciones son hechas en porcentaje del volumen intracraneal (%VIC) – ver Figura 1-. Esto ayuda a reducir la variabilidad entre pacientes [1] y por lo tanto a generar medidas poblacionales y comparaciones más robustas.
Es decir que lo que vamos a comparar entre estudios es el %VIC para las distintas áreas cerebrales segmentadas. En ese sentido, la comparación parece sencilla, solo hace falta mirar el valor del volumen para cada área en el estudio previo y en el estudio actual y calcular la diferencia. Sin embargo, hay fuentes naturales de variación entre dos mediciones realizadas en un/a mismo/a paciente que hacen más compleja esta comparación. Estas variaciones pueden deberse a cambios en el equipo de medición, cambios fisiológicos en el/la paciente (de hidratación, circadianos, etc) o pueden ser parte de la evolución normal de los volúmenes cerebrales con la edad [2]. Para poder separar los cambios de volumen significativos de otras variaciones tenemos que estudiar estas fuentes de variabilidad un poco más a fondo.
Evolución de los volúmenes cerebrales con el tiempo
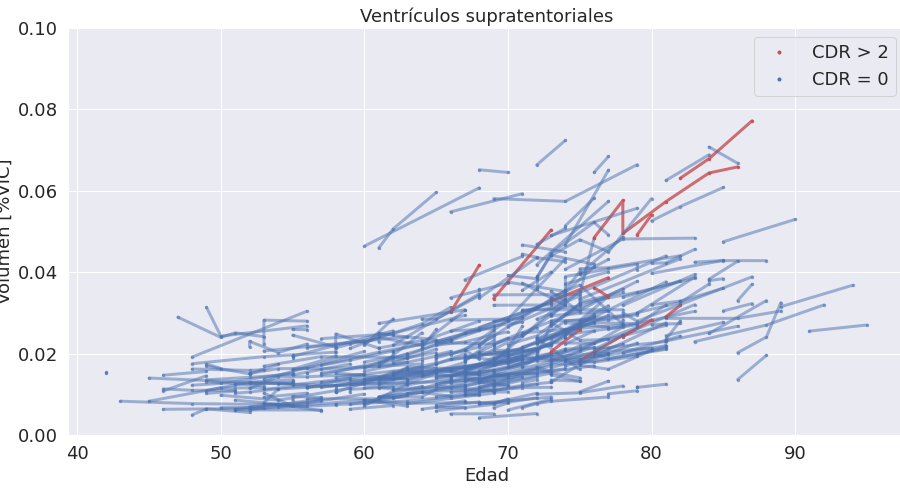
Para entender mejor el tipo de dato con el que tratamos, vamos poner el ejemplo de una estructura que presenta una gran variabilidad con la edad: el sistema ventricular; en particular vamos a analizar el volumen de los ventrículos supratentoriales (Figura 2).
No vamos a centrarnos acá en las variaciones que definen los percentiles normales para cada rango de edad ya que eso está contemplado en los rangos normativos que ya forman parte de los reportes de Entelai y se calculan en una base transversal mucho mayor. Vamos a concentrarnos en las variaciones intra-sujeto y las tasas de cambio. En ese sentido podemos observar varias cosas:
- El volumen a un dado tiempo es predictivo del volumen a tiempos futuros (las variaciones intrasujeto son mucho menores que las variaciones entre sujetos)
- Las tasas de cambio dependen tanto de la edad como del volumen inicial
- Las pendientes presentan cierta variabilidad aun para volumen y edad iniciales fijos
- Los/as pacientes con demencia moderada (CDR > 2) parecen tener pendientes mayores (aumentos más marcados) que sujetos con CDR = 0 de edad y volumen inicial comparables.
Si ajustamos un modelo estadístico capaz de capturar estas características tendremos una manera de estimar intervalos de predicción para valores futuros que nos permitan decidir si un cambio de volumen observado es mayor o menor que lo esperado para una dada población control.
Un modelo estadístico para el cambio temporal
Estuvimos evaluando diferentes modelos estadísticos para ajustar las variaciones observadas en la figura anterior. Hasta ahora el modelo que mejor se ajusta a nuestra base longitudinal es un modelo lineal que describe el volumen de una segunda visita para cada sujeto en base al volumen previo, la edad del paciente y la diferencia de tiempo entre visitas.
Es decir :
Donde Vij es el volumen del sujeto i en la medición j y Ej es la edad en la medición j
Una vez estimados los parámetros del modelo para cada área del cerebro a evaluar, se pueden calcular los intervalos de confianza de predicción. Dados un reporte anterior y conociendo la diferencia de tiempo entre el estudio actual y el previo se puede evaluar si el dato de volumen actual está dentro este intervalo (Figura 3).
En el caso marcado con rojo el segundo valor se encuentra por fuera de los intervalos de predicción del modelo. En cambio, en el caso verde, la segunda medición se encuentra dentro de los valores esperados para esa edad y volumen inicial. Este tipo de estrategias nos permite detectar áreas donde haya cambios de volúmenes que sean estadísticamente significativos y por lo tanto que requieren atención especial por parte del especialista. Cabe aclarar que detectar cambios de volumen aislados en ciertas áreas no constituye en sí un diagnóstico. Sin embargo aporta evidencia muy valiosa a la hora de evaluar el cuadro clínico en forma global. [3]
Evaluación de los umbrales en pacientes y controles
Para evaluar el funcionamiento de los umbrales podemos usar la separación en controles y pacientes con CDR ≥ 2 y observar qué ocurre con la fracción de cruce de los umbrales de los intervalos de predicción (Figura 4).
Podemos observar que los controles cruzan en proporciones similares ~ 4% por arriba y debajo de los intervalos de predicción. En cambio, los pacientes con CDR≥2 ocurren en una proporción mayor ~ 9 % por debajo y en proporción menor por encima ~ 3% de los umbrales.
Por otro lado hicimos el ranking de áreas que más tienden a ubicarse por encima y por debajo en cada caso. Observamos que, en los controles, las áreas aparecen distribuidas aparentemente al azar mientras que en el caso de los pacientes con CDR≥2 las áreas que caen predominantemente por debajo suelen ser regiones corticales de los lóbulos frontal y temporal. En contraste, en el caso de las áreas que suelen caer por arriba encontramos ventrículos y CSF. Esto es una confirmación de que las mediciones se están realizando de manera correcta y que se detectan las áreas que se saben que tienen un cambio de volumen significativo en demencia.
Lo que se viene…
Dados los avances presentados, esperamos poder contar pronto con nuevos reportes volumétricos que incluyan comparaciones longitudinales. Cuando esto ocurra vamos a estar explicando en detalle, por este mismo medio, los cambios en el reporte PDF que permitan una lectura rápida y directa de los cambios longitudinales. ¡Estamos en contacto!
Bibliografía
[1] Free, S. L., Bergin, P. S., Fish, D. R., Cook, M. J., Shorvon, S. D., & Stevens, J. M. (1995). Methods for normalization of hippocampal volumes measured with MR. American Journal of Neuroradiology, 16(4), 637-643.
[2] Sampat, M. P., Healy, B. C., Meier, D. S., Dell’Oglio, E., Liguori, M., & Guttmann, C. R. (2010). Disease modeling in multiple sclerosis: assessment and quantification of sources of variability in brain parenchymal fraction measurements. Neuroimage, 52(4), 1367-1373.
[3] Beadnall, H. N., Wang, C., Van Hecke, W., Ribbens, A., Billiet, T., & Barnett, M. H. (2019). Comparing longitudinal brain atrophy measurement techniques in a real-world multiple sclerosis clinical practice cohort: towards clinical integration?. Therapeutic advances in neurological disorders, 12, 1756286418823462.